WASHINGTON, DC - La Administración de Alimentos y Fármacos de Estados Unidos (FDA, en inglés) dio luz verde este lunes al uso de la primera vacuna para prevenir el virus sincitial respiratorio (VSR) en bebés que se administra a mujeres embarazadas.
El fármaco, comercializado con el nombre de Abrysvo y fabricado por Pfizer, fue respaldado también por la Agencia Europea de Medicamentos (EMA) en julio.
Manténte al tanto de las noticias locales y del estado del tiempo. >Suscríbete a nuestros newsletters gratuitos aquí.
Con su aprobación de este lunes, la FDA espera "ofrecer una opción a los trabajadores sanitarios y a las personas embarazadas para proteger a los bebés de esta enfermedad potencialmente mortal", dijo el regulador en un comunicado.
La agencia consideró que la seguridad y efectividad de la vacuna se han demostrado en una serie de estudios clínicos internacionales, en los que se detectó una reducción significativa del riesgo de sufrir casos graves de VSR en bebés hasta los seis meses de edad.
En mayo, la FDA aprobó el uso del fármaco para las personas mayores de 60 años.
Para que la vacuna pueda empezar a ser administrada a mujeres en el país, los Centros para el Control y la Prevención de Enfermedades (CDC) deben emitir primero una recomendación, según recoge el medio The Hill.
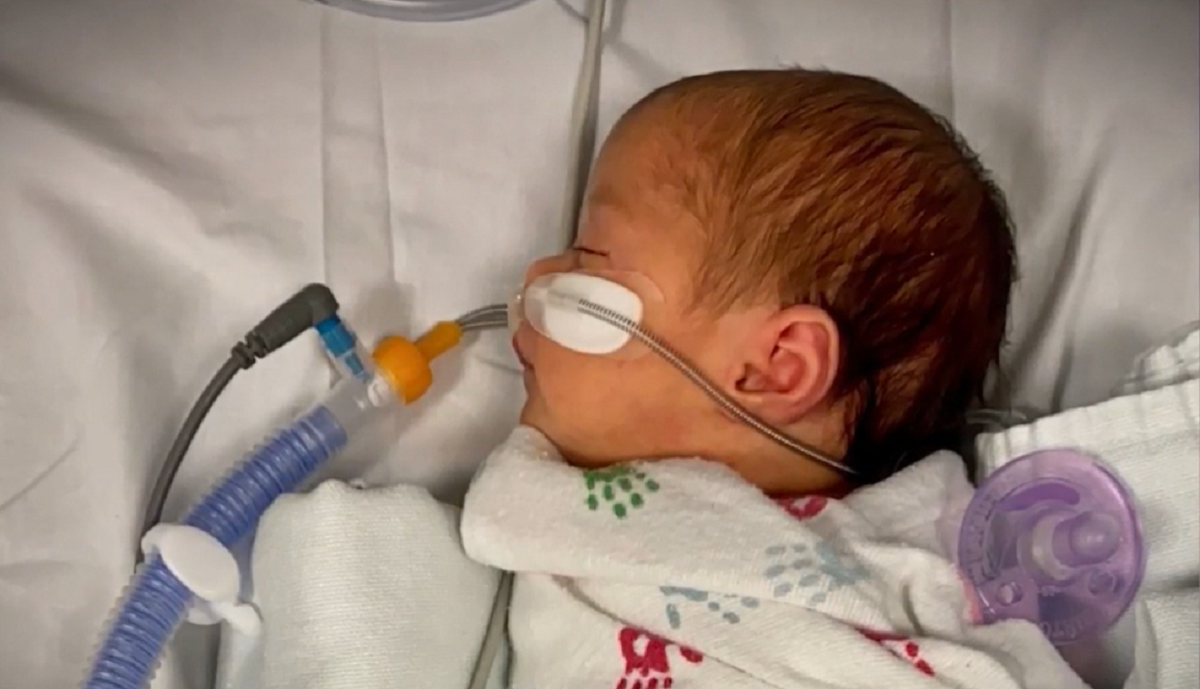
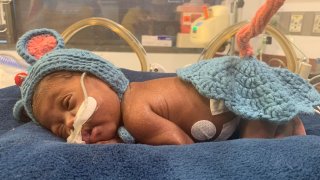
Según la FDA, el VSR es la principal causa de infecciones del tracto respiratorio inferior en bebés en el mundo. El virus suele comenzar a circular en otoño y llega a su pico en invierno.
Aunque en muchos casos solo provoca síntomas similares a los del resfriado, en ocasiones genera complicaciones y puede llegar a producir bronquitis o neumonía. Es especialmente peligroso durante el primer año de vida.
Según la FDA, los principales síntomas de Abrysvo en mujeres embarazadas son dolor en la zona de la inyección, dolor muscular, náuseas y dolor de cabeza.